| 経皮治療システム |
| 薬を体内に投与する方法はいくつか存在します。たとえば、薬を口から飲み込み、胃、腸内の消化管粘膜より体内に吸収する経口投与や、注射などで直接投与する方法があります。しかし前者の場合、薬物によっては肝臓でほとんど代謝される(肝初回通過効果)ため、効果的に作用するのが困難です。また後者の注射を利用する場合、薬効が長時間維持しない上に、痛みを伴うので患者の負担となります。 そこで、本研究室では薬物を効果的に目的部位に送達するDDS(Drug Delivery System)の一つである経皮送達システム(TTS:Transdermal Therapeutic System)について研究しています。TTSには次のような利点があります。 (1):肝臓での初回通過効果の回避ができる。 (2):長時間の連続投与が可能である。 (3):目的の部位に適量の薬物を効果的に与えることができる。 (4):必要性に応じて投与の中止が可能である。 このように、薬物の投与において非常に有効ですが、いくつかの欠点も同時に上げられます。 (5):角質層が物理的障壁となり薬物の速やかな透過を妨げている。 (6):皮膚内の酵素により代謝を受け、薬効が失活する可能性がある。 (7):有効血中濃度に達するのに時間がかかる。 これらの欠点を解決する方法としては、電場を利用する方法、超音波を利用するフォノフォレシス(phonophoresis)、薬物に化学修飾を施すプロドラッグ法等があります。 1:電場を利用した透過促進法 電場を利用した薬物の体内への透過促進法にはイオントフォレシス(iontophoresis)とエレクトロポレーション(electroporation)が存在します。イオントフォレシスは皮膚間に電流を流すことで電位勾配を与え、その電位勾配によりイオン性の薬物を透過(エレクトロフォレーシス:electrophoresis)する方法です。また、この方法ではイオン性の薬物だけでなく、水の+極から−極への移動(エレクトロオズモシス:elctroosmosis)に伴い非イオン性薬物の透過も促進することができます。 また、イオントフォレシスには電場を逆転するリバースイオントフォレシスがあり、この方法を使うことで薬物を体内から取り出すことも可能です。エレクトロポレーションは短時間のうちに高電圧を適応することで細胞膜・内に隙間を作り、そこを通過させることで体内に薬物を送り込む方法です。本研究室では主にイオントフォレシスによる薬物の透過促進について研究しています。 2:フォノフォレシス 超音波を利用して薬物の皮膚吸収を促進する方法にフォノフォレシスがあります。フォノフォレシスの薬物透過促進のメカニズムは不明な点が多いです。しかし、超音波を照射することで角質層の透過性がよくなるとか、超音波の照射により薬物の吸収性が改善されるとかが言われています。今後の課題としてはこの機構の解明が挙げられます。また、超音波はその強度によって人体に有害であると言われていますが、周波数、強度、適応部位、適応時間を調節することで、安全でかつ効果的な薬物皮膚透過促進が可能となります。 3:プロドラッグ(外力に化学ポテンシャルエネルギーを利用) プロドラッグは薬効のある親薬物に化学修飾を加えることで体内への透過を促進し、その後体内で親薬物に変換し薬効を発現する薬物のことを言います。経皮治療システムで用いられるプロドラッグは、プロドラッグ化することで皮膚角質層への親和力を高め、物理的障壁となる角質層を速やかに透過することができます。さらに、角質層を通過したプロドラッグは表皮や真皮、さらに全身循環系で酵素により親薬物に代謝し薬効を発現します。また、逆に吸収部位で薬効を発現させた後代謝し、副作用の発現を抑えるよう作られたソフトドラッグとかアンテドラッグと呼ばれる物もあります。 本研究室では、種々のプロドラッグやプロビタミンを使い薬物の皮膚透過性を高め、さらに、プロドラッグを利用した薬物透過の時間制御について研究しています。 |
| 眼科薬物送達システム |
|
眼内の疾患(緑内障や白内障など)には、点眼薬や経口剤が用いられています。しかし、眼内へ到達するのは、投与された薬物の1%にも満たない量しかありません。そこで、角膜や水晶体組織での薬物透過性を測定し、効果的な投与方法の検討を行っています。さらに薬物の透過促進に電場や超音波等が利用できるか検討もしています。また、生体内で分解するポリマ−(*下記参照)を用いて、直径1mmほどのロッドを作成しています。このロッドを用いて、薬物を長期間(6ヶ月や1年間)一定放出することにより、患者への負担を軽減することが可能になります。
<生分解性ポリマーを用いた埋め込み型製剤> 生分解性polymer rodからの薬物の0次放出 【目的】ポリ乳酸ロッド型製剤を2段階放出型(Non-melt法)、一定放出型(Melt法)の2つの方法で作製し、それぞれの薬物放出挙動をin-vitro実験で検討した。 【方法】L-ポリ乳酸(重量平均分子量5000L-PLA)を基剤とし、インドメタシン(IM)をモデル薬物とした埋め込みロッド型製剤を作製した。ロッド型製剤は、L-PLAの重量に対して薬物濃度10%となるように、Non-melt法およびMelt法で作製した。作製したロッド型製剤を10ml遮光瓶に入れ、レセプター液(pH7.2リン酸塩緩衝液)を5ml加えて37℃で振とう[100cpm]した。経時的に全液量をサンプリングし、新しいレセプター液5mlを加えた。レセプター薬物濃度は分光光度計(UV-3100PC, 島津製作所社製、検出波長320nm)で定量した。 【結果と考察】Fig.1にNon-melt法、Melt法で作製したロッド型製剤からの薬物放出挙動を示す。Non-melt法で作製したロッド型製剤は、まず表面近傍薬物の拡散/溶解によってファーストバースティングが起きた。その後ゆるやかな薬物放出を経てポリマーの加水分解に伴うセカンドバースティングが起きた。Melt法で作製したロッド型製剤では、Non-melt法で作製したロッド型製剤同様、ファーストバースティングが起きた。しかしその後、薬物の一定放出が2週間続いた。 Non-melt法で作製したロッド型製剤では、セカンドバースティングが起こるため薬物放出の制御が難しく副作用の危険性がある。しかし、本研究におけるMelt法ロッド型製剤はセカンドバースティングを起こさず、薬物0次放出を示すことが明らかとなった。よってMelt法ロッド型製剤は、急激な薬物放出に伴う副作用の危険性が少なく、より多くの疾患への適応が期待できる。 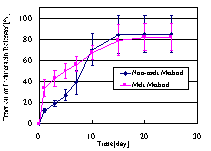 (Fig.1) (Fig.1)
|
| DDS設計支援薬物動態シミュレーション |
| 薬物を皮膚や眼に投与した場合、複雑な過程を経て全身および組織内へ分布していきます。この分布の仕方は、適当なモデル式を構築することにより予測が可能です。私達は経皮治療システムにおけるSKIN-CAD™、眼科DDSにおけるEYE-VP™等の体内動態モデルを提案しています。これらのモデルでは、今までに報告されている数学モデルで考慮できなかった、電場等の薬物透過促進法だけでなく、皮膚や眼内での代謝作用も考慮できます。これらのモデルにより、実験での測定が難しい組織内濃度分布や時間変化の予測ができ、またヒト臨床デ−タと動物実験デ−タとの関係を橋渡しすることにより、新規薬物投与方法の開発の手助けとなります。
<経皮治療システム設計用薬物動態解析ソフト:SKIN-CAD™> 経皮治療システムの最適製剤設計には、薬物の皮膚吸収挙動と血中移行後の体内動態を正確に理解する必要があります。最近の計算機の性能向上に伴い、経皮吸収の複雑な動的挙動を容易に解析できるようになりました。そのため、治療システム研究の実験的アプローチ(in-vivo/in-vitro)に計算機科学的アプローチ(in-silico)を援用する新しい研究手法が進展しています。 当研究室では現在、経皮治療システムのin-vivo/in-vitro/in-silico薬物動態解析ツールとしてSKIN-CAD™というコンピュータソフトウェア(Windows用)を開発しています。 SKIN-CAD™では、主に薬物の累積皮膚透過量、血中濃度、皮膚内薬物濃度分布の経時変化を予測します。受動拡散(Passive Diffusion)ばかりでなく、皮内における薬物の結合や代謝、IontophoresisやPhonophoresisによる透過促進を考慮したシミュレーションが可能です。 SKIN-CAD™は薬物の経皮吸収における種々の因子の影響を定量的に評価でき、最適な製剤設計及び投与計画を容易に決定できます。SKIN-CAD™はin-vivo/in-vitro/in-silico相関を検討するための一手段として、経皮治療システムの研究・開発にとって有用性の高いツールであると言えます。 今後、薬物の皮内及び体内動態を最小限の動物実験や臨床試験から正確に予測することができるように、SKIN-CAD™をさらに発展させていく予定です。 将来的には、このSKIN-CAD™のようなソフトウェアは、体内動態における個体差の影響を数値実験することに用いられ、臨床試験の役割をある程度担える手段、医療の現場で患者に対する服薬指導法のツールなどに利用できると思われます。 <眼内薬物動態解析ソフト:EYE-VP™> 眼科製剤の問題点…人間は生命を維持するための多くの情報を五感、すなわち視覚、聴覚、嗅覚、味覚触覚により入手しています。特に人間の視覚は生きていくうえで重要な情報の約80%を収集しているため、眼疾患による視覚障害および視覚喪失は日常生活に重大な影響をもたらすことになります。したがって、眼疾患に有効な製剤の開発が必要となってきます。有効な製剤として埋め込み剤や点眼剤が利用されています。しかし、標的部位に薬物を届かせることは困難です。それは、眼内には多くの防御機能が備わっているためです。製剤設計などではいつもこの防御機能のことをいつも考えなければなりません。 【目的】製剤設計ではこの防御機能をいかに効率よく突破するかを考慮しなければなりません。そのため、生体内の実験を数多く行い、製剤の生体内防御機能における薬物消失を知る必要があります。しかし、生体内の実験をいつも同じ結果が出るとは限らずまた数多く行うことが難しい面があります。そこでin-vitro(生体外)実験を行うことにより、In Vivo(生体内)における眼内薬物濃度変化を知ることができるシミュレーションが必要となってきます。そこで、我々は眼内薬物濃度変化を知ることができるシミュレータを作成することを目的としています。 【今後】眼科製剤の設計を補助するシミュレータの作成、そして医師が患者にわかりやすく投薬指示を行えるようなシミュレータの作成を行う。 |
このページに関する質問は