Hamano Lab
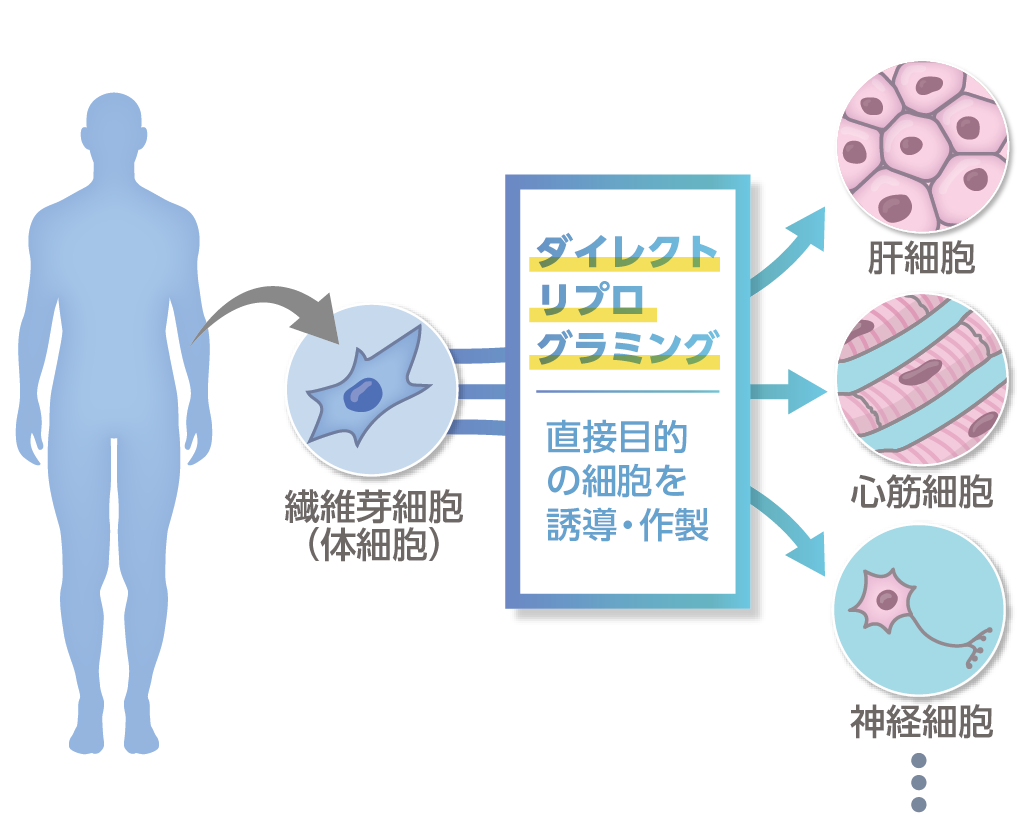
1 細胞が分化する仕組みの解明と新規な細胞分化誘導法の開発
私たちの体は約数百種類の細胞から構成されていますが、それらの細胞はたった1つの細胞から分化という過程を経て作られています。近年ではその仕組みを応用して、多能性幹細胞(iPS細胞)から治療する患部に移植するための細胞が作製されています。また、複数の候補薬から個々人の体質や病状に最適な薬を探索するためのスクリーニングにも分化させた細胞が用いられています。当研究室では細胞分化の仕組みを生体のビックデータ(マルチオミクスデータ)から解き明かし、その仕組みを制御する転写因子や薬を予測することで体細胞からさまざまな細胞を直接変換する細胞作製法を開発しています。iPS細胞を介さずに直接目的の細胞を誘導する方法である「ダイレクトリプログラミング」によって、既に確立されている細胞作製法よりも早く、より安全な作製法を開発することで細胞治療法や創薬に貢献することを目指しています。
2 医療現場の精密な診断や意思決定をサポートするAI技術の開発
臨床現場では個々人に即した適切な治療を提供するために、多様な病態を精密に診断する必要があります。診断の重要な指標の一つである病理画像は、熟練した臨床医の経験則に基づいて1枚1枚確認がなされ、治療方針の決定に用いられています。医療業務の効率化や人の目では判別不可能な病態を精密に診断することを目指し、当研究室では病理画像から疾患の有無や病態のステージを判別するAI技術の開発をしています。現在は、日本を始めとした世界的な死因の上位に位置する循環器疾患に対して最新の深層学習を取り入れた判別精度の高いAIモデルを臨床医の先生方と共同で開発しています。

3 人工知能によるAI創薬
新薬を開発するためには、複雑な病気のメカニズムを理解し、創薬標的の同定と新たな化合物候補を探索する必要があります。候補となる化合物や創薬標的は膨大にある一方で、副作用が生じるなどの様々な理由により最終的に臨床試験を突破できる薬はごくわずかであることから、医薬品候補の効率的な探索が切望されています。当研究室では、疾患時の一細胞レベルにおけるマルチオミクスデータ、ヒトゲノムにコードされている創薬標的タンパク質や治療候補薬の立体構造などの膨大な情報を深層学習により統合解析することで、創薬標的や新規治療薬を探索する研究をしています。
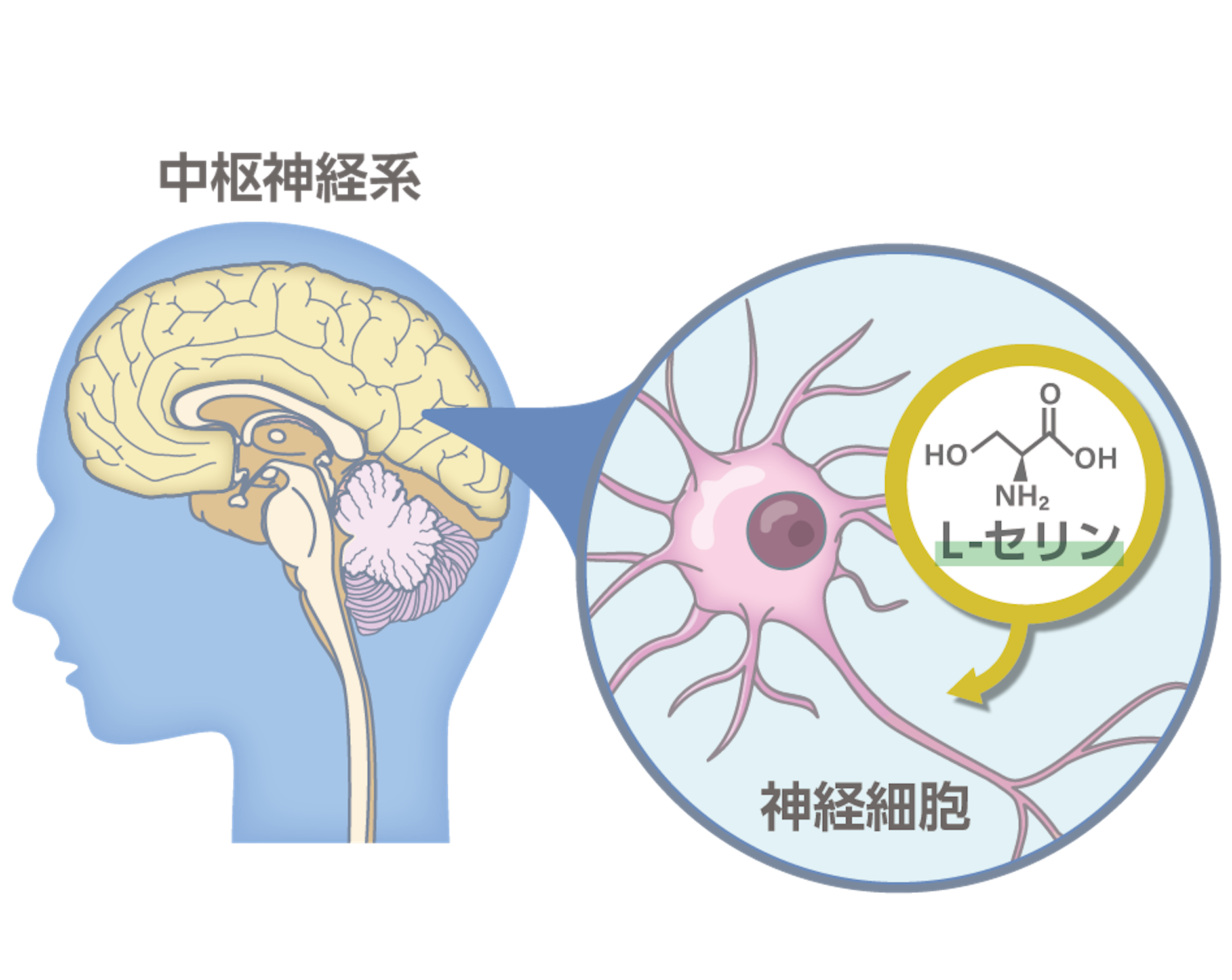
4 中枢神経系における非必須アミノ酸の生理機能性の解明
タンパク質を構成する天然アミノ酸のうち一部は生合成経路が進化的に広く保存されているため、アミノ酸は十分な必要量が自身の生合成によって常に賄われていると考えられており、また、単なるタンパク質の原材料としてこれまで軽視されてきました。アミノ酸はタンパク質としてではなくアミノ酸単体で全身の様々な生理機能を調整していることを皆さんはご存知でしょうか。ヒト臓器のうち、特に脳ではアミノ酸が臓器の機能を直接担っている場所であり、神経伝達物質や神経栄養因子として記憶や学習などの脳高次機能を司っています。近年では、一見不足しないと思われていたアミノ酸の合成能と供給量が低下することで神経変性疾患や精神疾患、肝疾患等の原因となることが報告されています。そこで当研究室では生体内で合成可能な非必須アミノ酸のうち特にL-セリンに着目し、中枢神経系を中心として生理機能性や疾患との関連を細胞レベルから探索しています。
Previous research
- 医用画像から心不全の治療予後を予測する深層学習モデルの開発(2023年度 修士論文)
- 皮膚線維芽細胞から膵β細胞へのダイレクトリプログラミングを誘導する転写因子の予測(2023年度 卒業論文)
- 統合失調症様マウスの脳内分子機序の解明と創薬提案(2023年度 卒業論文)
- 細胞特異的トランスクリプトームを用いたダイレクトリプログラミング誘導低分子化合物の予測(2022年度 卒業論文)
- シングルセル解析を用いた心不全治療のための生体内リプログラミング誘導転写因子の予測(2022年度 卒業論文)
- ⼼筋細胞核及びDNA損傷マーカーの染⾊画像を⽤いた⼼不全の治療予後予測モデルの構築(2021年度 卒業論文)
- 血管内皮細胞から肝細胞をダイレクトリプログラミングにより誘導する低分子化合物の組み合わせ(2021年度 卒業論文)